某些病变部位如炎症、缺血、感染及肿瘤组织,其生理性质与正常组织不同,这为纳米载体在病变部位生理响应性地释放治疗药物提供了机会。除此之外,可以通过人为地对病变组织施加外源性刺激如升温或降温、光照、磁场,超声等,诱导纳米载体定时定量释放药物,进一步扩大刺激响应性纳米载体的应用。与血液和正常组织液pH7.4相比,肿瘤组织的pH环境偏酸性,如细胞外液pH 6.5-7.2,细胞内涵体pH5.0-6.5及溶酶体pH4.5-5.5。因此,充分利用肿瘤部位与正常组织pH值的差异,设计出在正常组织缓慢释放而在肿瘤组织PH响应性快速释放抗肿瘤药物的纳米载体,是当前增强抗肿瘤疗效的有效手段之一。
我校唐星教授课题组,通过制备具有复合核结构的PH响应的PEG-PLGA-PGlu纳米载体,实现阿霉素在肿瘤细胞内的快速释放,从而增强其抗肿瘤疗效。相关结果以专题文章的形式发表在Journal of Biomedical Nanotechnology杂志上(IF=5.338, Self-Assembled Monomethoxy (PolyethyleneGlycol)-b –P (D,L- Lactic -co-Glycolic Acid)-b-P(L-Glutamic Acid) Hybrid-Core Nano particles for Intracellular pH-Triggered Release of Doxorubicin,2015,11(8):1354-1369)。
聚乙二醇-聚乳酸聚羟基乙酸(PEG-PLGA)是构建自组装纳米载体的常用材料,但该类聚合物存在如下缺陷:(1)载药量低。该类聚合物组装的胶束通常仅能载疏水性药物,且载药量较低;虽然其组装的聚合物囊泡内水相能装载亲水性药物,但因内水相体积有限,载药量也较低;(2)体内稳定性差。静脉注射进入血液时,由于血液的稀释及血液中蛋白的相互作用,很容易破坏自组装的纳米结构,使得所装载的药物泄漏;(3)可以利用的功能基团有限。PLGA疏水链仅存在惰性的酯键和末端单羟基,可用于修饰的基团有限。聚谷氨酸(PGlu)的侧链含有多个γ位羧基,可以为水溶性的阳离子型药物提供结合位点而提高载药量。而且,在一定的pH范围内,该基团解离状态“开-关”效应使PGlu链二级构象呈pH依赖性转变,如水溶性的无序卷曲状向疏水性的α-螺旋转变。这种构象转变赋予该类聚合物构建的纳米载体pH敏感的药物释放行为,这对病变部位环境响应性释放药物极其有利。
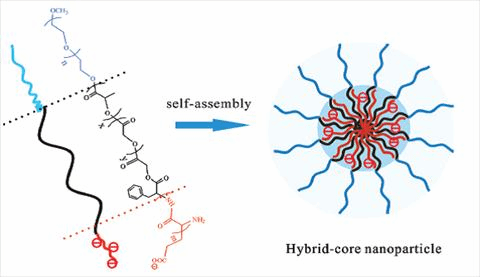
如图所示,本研究以PEG为亲水段,PLGA为疏水段,PGlu为功能段构建了结构新颖的PEG-PLGA-PGlu三嵌段共聚物,通过PGlu侧链的羧基阴离子与阿霉素的氨基阳离子静电复合,有效递送抗肿瘤药物阿霉素。该新型三嵌段共聚物自组装形成的纳米粒具有如下特点:(1)功能性的PGlu能提供药物结合位点,与阳离子药物经静电作用,形成静电复合物以提高载药量;(2)自组装的纳米载体具有PH敏感性,使得装载的阿霉素在肿瘤部位快速释放,从而增强抗肿瘤疗效;(3)自组装形成复合核,长的疏水性PLGA链对静电复合物进行包埋,可以提高纳米粒载药稳定性,减少药物泄露;而亲水PEG以刷状构象分布在纳米粒表面,减弱纳米粒被网状内皮系统(RES)快速吞噬,使其在血液内具有长循环作用。实验数据表明,与阿霉素注射液相比,PH响应性的纳米粒组表现出更优的细胞毒性。