近日,美国化学学会旗下期刊ACS Nano(IF=16,Q1)在线发表了我校药学院张宇教授团队的最新研究成果,题为“Oxygen-Generating Transdermal Nanoplatform Co-Delivering BRD4 Proteolysis Targeting Chimera/ Verteporfin/ CaO2 Synergistically Remodels Immunosuppressive Melanoma Microenvironment to Potentiate Combination Immunotherapy”。
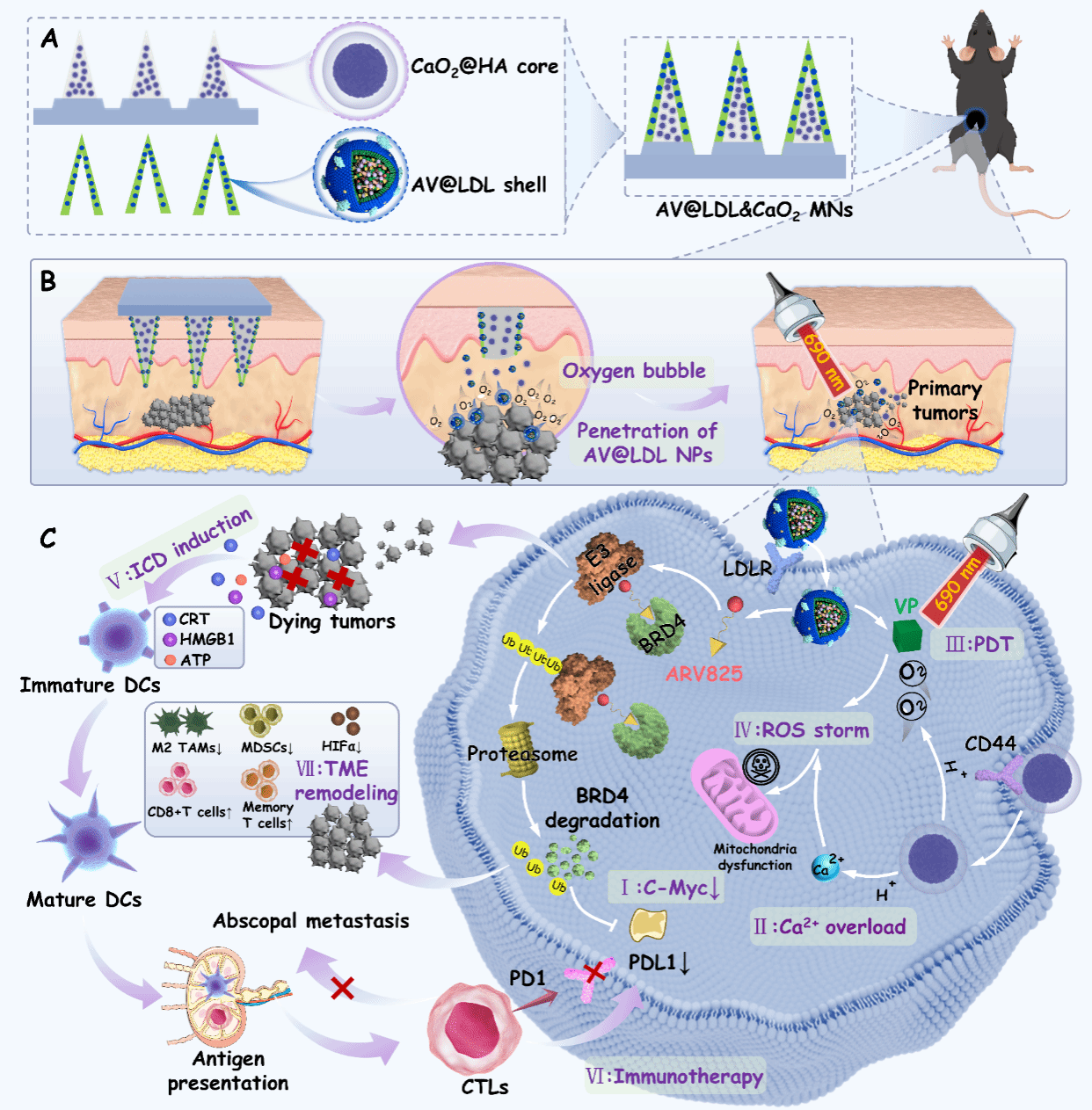
黑色素瘤术后复发与转移仍是临床治疗中的重大挑战。肿瘤免疫微环境普遍具有低免疫原性与强免疫抑制性的特征,如大量M2型肿瘤相关巨噬细胞浸润、Treg细胞活跃及显著缺氧等,这些因素共同削弱了免疫治疗的疗效。针对上述问题,研究团队构建了一种可自供氧的核—壳结构微针贴片,用于向术后黑色素瘤局部精准递送BRD4 PROTAC分子(ARV825)、光敏剂维替泊芬(VP)及氧化钙纳米颗粒,旨在通过多模式协同治疗有效抑制肿瘤复发与转移。研究中,团队首先将ARV825和VP共同包载于重组低密度脂蛋白纳米颗粒(LDL NPs)的疏水核心中,制备得到AV@LDL NPs。随后,以可溶性透明质酸(HA)为外层基质,将AV@LDL NPs装载于微针壳层,并在微针核心部分引入HA修饰的CaO2纳米颗粒(HA@ CaO2 NPs),构建出具有空间分区特征的复合微针系统(AV@LDL&CaO2 MNs)。微针插入术后肿瘤部位后,其针体迅速溶解,释放的AV@LDL NPs与HA@ CaO2 NPs可在肿瘤组织内实现高效局部富集。其中,AV@LDL NPs具有优异的肿瘤深部渗透能力,并能通过低密度脂蛋白受体(LDLR)介导的内吞作用实现高效细胞摄取,从而克服传统PROTAC分子或光敏剂全身递送中存在的靶向性差、肿瘤蓄积不足等局限。在光照激发下,VP产生活性氧(ROS),与ARV825介导的表观遗传调控治疗(BRD4蛋白降解)协同作用,可有效清除术后残余肿瘤。同时,HA@ CaO2通过持续供氧与Ca2+过载双重机制,显著增强光动力治疗效能,并诱导免疫原性细胞死亡(ICD),激活机体的抗肿瘤免疫应答。此外,ARV825介导的BRD4降解可下调M2型TAMs的浸润并抑制肿瘤组织中PD-L1表达,与供氧作用协同重塑免疫抑制性肿瘤微环境,进一步放大细胞毒性T淋巴细胞(CTL)的抗肿瘤活性。该研究所构建的AV@LDL& CaO2微针平台可显著提升肿瘤免疫原性、逆转免疫抑制性肿瘤微环境,以低剂量、低毒性、高效能实现术后黑色素瘤的精准治疗,同时具备操作简便、患者依从性高的给药优势,为术后黑色素瘤治疗提供了一种安全高效的新策略。
2023级博士研究生魏铭励为论文第一作者,药学院张宇教授为本文通讯作者,文章得到唐星教授的指导与支持,沈阳药科大学为唯一通讯单位。该研究得到了国家自然科学基金(No. 82172086)的资助。
原文链接:https://doi.org/10.1021/acsnano.5c04580